Monitorización en tiempo real de la síntesis de péptidos en fase sólida
La producción de péptidos es hoy en día una parte indispensable de la investigación y la producción farmacéutica moderna. Los péptidos son compuestos orgánicos formados por aminoácidos unidos mediante enlaces peptídicos. Pertenecen a las clases importantes de principios activos farmacéuticos (API, por sus siglas en inglés) y constituyen la base de numerosos medicamentos. Se utilizan, entre otras cosas, en terapias contra el cáncer, la diabetes o las enfermedades autoinmunes. Sin embargo, su producción es compleja, requiere mucho tiempo y conlleva un alto consumo de disolventes. La síntesis de péptidos en fase sólida (SPPS) es un método muy utilizado para la producción de péptidos.
Proceso de síntesis de péptidos en fase sólida
La síntesis de péptidos en fase sólida fue desarrollada en 1963 por Bruce Merrifield y revolucionó la química de los péptidos. Su principio se basa en que la cadena peptídica en crecimiento se une a una resina insoluble que se suspende en un disolvente.
El proceso de síntesis consiste en ciclos recurrentes de:
-
-
- Acoplamiento: un aminoácido protegido se añade junto con reactivos de acoplamiento al extremo libre de la cadena peptídica.
- Lavado: Los aminoácidos no convertidos y el exceso de reactivos se eliminan mediante enjuague.
- Eliminación del grupo protector: Se elimina el grupo protector del aminoácido recién añadido para dejar al descubierto el siguiente extremo de unión.
- Nuevo lavado: se eliminan los residuos de los grupos protectores y los subproductos.
Este ciclo se repite hasta que se completa la secuencia deseada. Por último, toda la cadena peptídica se separa de la resina y se purifica.
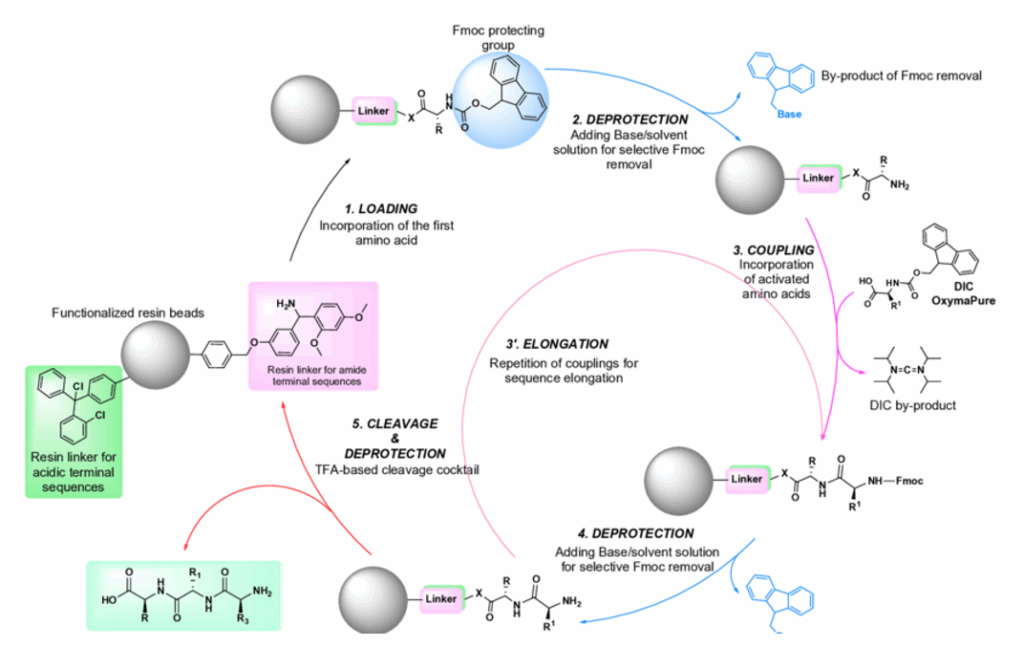 Figura 1: Ejemplo de funcionamiento de un SPPS (fuente: https://www.researchgate.net/figure/General-scheme-of-solid-phase-peptide-synthesis-SPPS-steps_fig4_366806988)
Retos en la síntesis de péptidos
Figura 1: Ejemplo de funcionamiento de un SPPS (fuente: https://www.researchgate.net/figure/General-scheme-of-solid-phase-peptide-synthesis-SPPS-steps_fig4_366806988)
Retos en la síntesis de péptidos
Por lo tanto, un factor decisivo para la calidad y la rentabilidad de la síntesis de péptidos en fase sólida es la supervisión continua del proceso. Los métodos utilizados hasta ahora, como el análisis HPLC, las pruebas de ninhidrina o cloranil y la absorción UV, pueden proporcionar información valiosa, pero tienen graves inconvenientes: requieren mucho tiempo, son destructivos, exigen la toma de muestras y, a menudo, provocan interrupciones en todo el proceso de producción. El SPPS es similar a una caja negra, ya que no se pueden aislar productos intermedios durante el proceso en curso y el resultado final sigue siendo incierto hasta que se completa la síntesis. Aquí es donde entra en juego la medición en línea o en línea con un refractómetro. El índice de refracción (RI) de una solución depende directamente de su composición. Cada reacción, ya sea la unión de un aminoácido a la resina, la eliminación de un grupo protector o un paso de lavado, modifica la concentración de las sustancias disueltas en el sistema y, con ello, el índice de refracción. Estos cambios pueden medirse con precisión y en tiempo real con los refractómetros modernos. De este modo, la síntesis de péptidos en fase sólida se vuelve transparente y controlable.
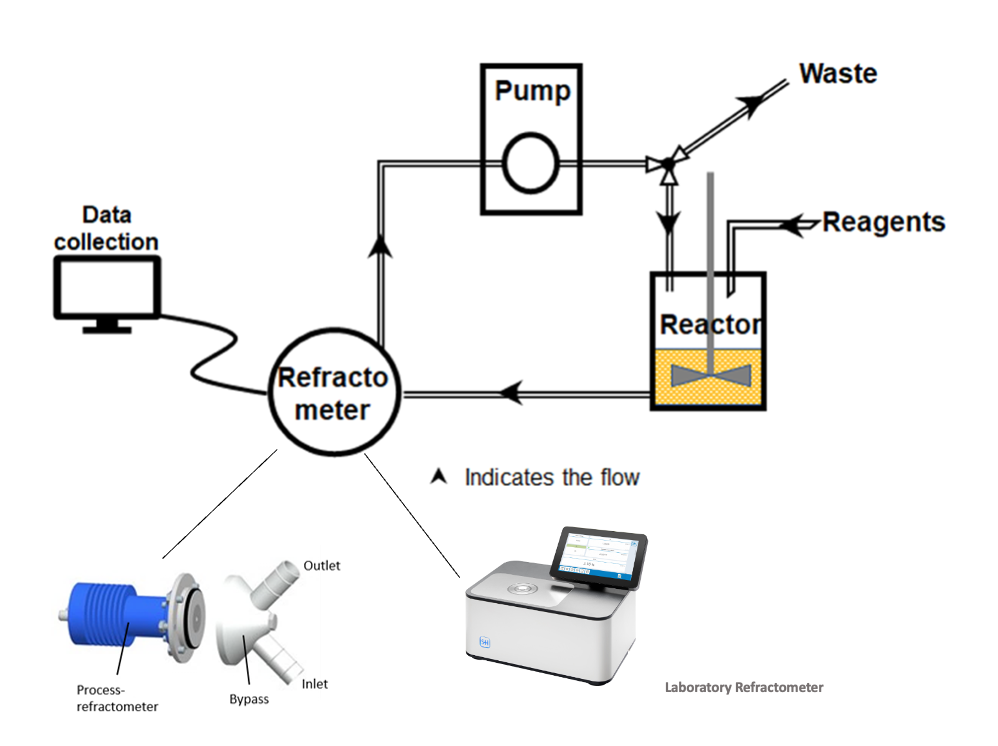 Figura 2: Estructura esquemática de un SPPS con refractómetros (fuente: https://pubs.acs.org/doi/10.1021/acs.oprd.1c00051
Figura 2: Estructura esquemática de un SPPS con refractómetros (fuente: https://pubs.acs.org/doi/10.1021/acs.oprd.1c00051
Un refractómetro ofrece la gran ventaja de que se trata de un método de medición continuo y no destructivo que no requiere la toma de muestras. Los datos están disponibles de inmediato y proporcionan información valiosa sobre el progreso de cada paso de síntesis. Por ejemplo, se puede seguir en directo la carga de la resina. Del mismo modo, se pueden detectar los pasos de taponado o la eliminación de grupos protectores mediante curvas de señal características. Los ciclos de lavado con disolventes como el DMF también se reflejan claramente en las mediciones y, por lo tanto, se pueden optimizar en términos de eficiencia y duración.
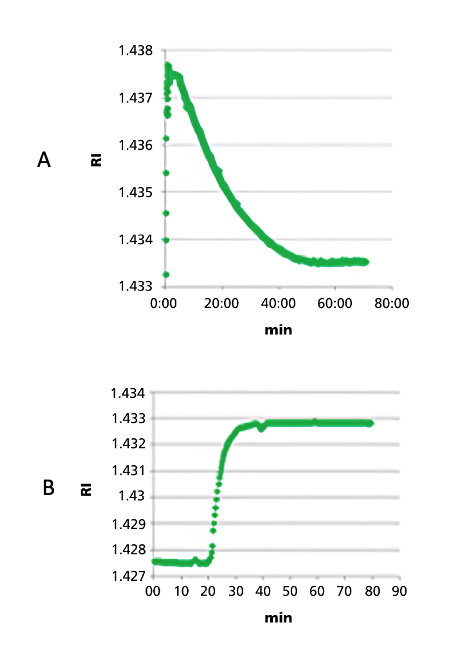 Figura 3: Evolución del RI durante el proceso de acoplamiento (A) y la eliminación del grupo protector (B) (Fuente: https://pubs.acs.org/doi/10.1021/acs.oprd.1c00051)
Figura 3: Evolución del RI durante el proceso de acoplamiento (A) y la eliminación del grupo protector (B) (Fuente: https://pubs.acs.org/doi/10.1021/acs.oprd.1c00051)
Esto no solo aumenta la seguridad del proceso, sino también la eficiencia: los tiempos de producción se reducen de varias horas a unos pocos minutos, los reactivos se pueden utilizar de forma más económica y se reduce el consumo de disolventes. De este modo, un refractómetro contribuye de manera significativa a una producción de péptidos más sostenible y económica, en consonancia con los modernos enfoques de «química verde». Además, la monitorización en tiempo real permite una amplia automatización del SPPS y sienta las bases para una escalabilidad fiable desde los ensayos de laboratorio hasta la producción industrial.
Para aprovechar al máximo estas ventajas, SCHMIDT + HAENSCH ofrece soluciones para diferentes ámbitos de aplicación: para instalaciones de laboratorio más pequeñas, por ejemplo, es adecuado el refractómetro de laboratorio VariRef. En combinación con la puerta de la cámara de muestras de flujo y una bomba de membrana, se pueden supervisar sin problemas volúmenes de unos pocos mililitros hasta varios litros. Para la escala industrial se puede utilizar, por ejemplo, el refractómetro de proceso en línea iPR B4. Este refractómetro en línea se puede instalar tanto en un sistema de derivación como directamente en línea en reactores o tuberías. Está diseñado para un funcionamiento continuo y permite un control constante del proceso, incluso en condiciones de producción exigentes.
Sus ventajas de un vistazo
-
- Ahorro considerable de tiempo en todos los pasos
- Datos en tiempo real en lugar de análisis offline con retraso
- Medición continua y no destructiva sin toma de muestras
- Detección precisa del punto final al acoplar y desacoplar el grupo de protección
- Pasos de lavado optimizados y consumo reducido de disolventes
- Mayor seguridad de proceso, reproducibilidad y automatización
- Ahorro de costes gracias al menor consumo de reactivos
- Síntesis más sostenible gracias a la reducción de residuos y del consumo energético
Los refractómetros de SCHMIDT + HAENSCH ofrecen así una herramienta integral para el control de procesos en la síntesis de péptidos. Combinan la máxima precisión con la facilidad de uso y permiten una mejora significativa de la calidad, al tiempo que ahorran costes y tiempo. Con estas tecnologías, la síntesis de péptidos no solo es más eficiente, sino también más sostenible, desde la investigación básica hasta la producción a gran escala.


